Vlákna mezibuněčné hmoty
- By: Filip Stráňavský
- Blog
Fascie jako mřížka z vláken
Fasciální síť je mřížka nebo pletivo (Benetazzo a kol., 2011), které je tvořeno převážně kolagenními vlákny. Ty jsou produkovány fibroblasty na základě biomechanických a biochemických požadavků (Stecco, 2015), které jsou v těle přítomny a které na tělo působí.

Kolagenní vlákna jsou protkána elastickými vlákny, která se spojují a vytvářejí lepivý gel ve formě proteoglykanů (Kannus, 2000). Vše je ponořeno do vodného prostředí (základní látky), které pomáhá jednotlivým buňkám komunikovat, vyměňovat si mezi sebou živiny a informace.
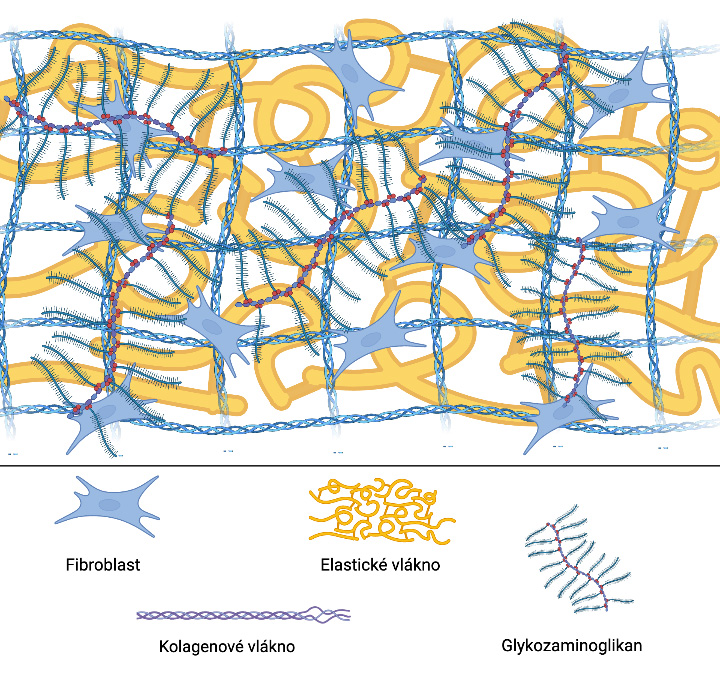
Například retikulární fasciální tkáně musí neustále promazávat klouzání pod nimi ležících šlach. Mají více než desetkrát vyšší obsah hyaluronanu a glykosaminoglykanu (GAG) (který působí jako lubrikant) než epimysiální fascie, která obklopuje svaly, a díky tomu jsou střižné síly nižší (Fede et al., 2018).
Hlavní představitelé fasciálních vláken
Tři hlavní zástupci vláken fasciální sítě jsou:
- kolagen,
- elastín a
- retikulín.
| Vlákna pojivové tkáně | ||
| Kolagenová vlákna | Elastická vlákna | Retikulární vlákna |
| Tvrdé, flexibilní | Nejtenčí | Nejtenčí Tenký kolagen |
| Odolnost proti roztažení | Vyrobeno z elastinu | Pokryté glykoproteiny |
| Šlachy, vazy | Natahovací se zpětný rázem (recoil) |
Fascie je vlastně voda a kolagen pod hydraulickým tlakem. Vlákna zajišťují mechanické vlastnosti pojivových tkání. Kolagenová vlákna jsou ponořena do tekutého gelu fascie, což dává vláknům a tekutině viskoelastické vlastnosti newtonovské tekutiny (Parrisi a Allen, 2019). To znamená, že fascie se může chovat nesčetnými způsoby. To závisí na délce, tvaru a hustotě kolagenových vláken a viskozitě různých gelů, s nimiž jsou smíchány.
Kolagen – základ pojivové tkáně
Kolagen je hlavní strukturální bílkovinou pojivové tkáně. Název kolagen pochází z řeckého κόλλα (kólla), což znamená „lepidlo“, a přípony γέν, -gen, což znamená „vyrábět“. Životnost kolagenového vlákna se liší v závislosti na typu kolagenu (Lesondak a spol., 2021).
Vědci používají pro popis životnosti kolagenového vlákna termín „doba obnovy“, který se vztahuje k biochemickému cyklu. Je to míra toho, jak dlouho trvá naplnění nebo vyprázdnění určitého zásobníku živin. Doba obratu lidského kolagenu se odhaduje na 300 až 500 dní (Currier a Nelson, 1992).

Existuje mnoho typů kolagenu a téměř 90 % kolagenu ve svalu se nachází v perimysiu (McCormick, 1994). Přestože v hluboké fascii jsou paralelní kolagenní vlákna, existují další vrstvy, které mají odlišnou orientaci vláken, což umožňuje přenos síly v různých vícesměrných rovinách (Purslow, 2010). Mechanické zatížení a tah zvyšují syntézu kolagenu, a tím zvyšují jeho odolnost vůči zatížení.
Mechanické vlastnosti šlach a vazů závisí na vlastnostech kolagenních vláken (typ, hustota, průměr, orientace). Suchou hmotu šlach a vazů tvoří převážně kolagen (60-85 %), z toho kolagen typu I tvoří přibližně 60 % u šlach a až 85 % u vazů. Nicméně bylo zjištěno, že exprese kolagenu typu III v patelární šlaše je vyšší u premenopauzálních žen než u mužů (Sullivan et al., 2009). Kolagen typu III je spojen s větší elasticitou tkání, což odpovídá nižší tuhosti šlach a vazů.
Obsah kolagenu ve vazech a šlachách je dán rovnováhou mezi rychlostí syntézy kolagenních bílkovin a rychlostí jejich degradace. Obnova šlachového kolagenu je však pomalá (Heinemeier a spol., 2018).
Různé typy kolagenu
Existuje 28 různých kolagenních proteinů (Ricard-Blum, 2011). V muskuloskeletálních pojivových tkáních tvoří kolagen typu I více než 90 % frakce kolagenu a velkou část zbývající frakce tvoří kolagen typu III. Kolageny typu I a III jsou tedy hlavními fibrilárními kolageny, které zajišťují pevnost v tahu muskuloskeletálních pojivových tkání (Kjaer, 2004).
V tabulce níže je uvedeno 5 typů kolagenu. Je jich však více. Ostatní typy však prozatím nejsou důležité.
| Typy kolagenu | Místa výskytu |
| Typ I | Kosti, šlachy, orgánové kapsle |
| Typ II | Hyalinní a elastická chrupavka |
| Typ III | Retikulární vlákna |
| Typ IV | Bazální lamina spojená s epiteliálními a endoteliálními buňkami |
| Typ V | Bazální lamina spojená se svaly |

Elastická vlákna
Elastinová vlákna jsou tenčí než kolagenová a tvoří trojrozměrnou síť kolem kolagenových vláken. Elastin je bílkovina, která dodává kolagenu schopnost snášet natažení (stretch) a roztažení (distension). Elastinová a kolagenová vlákna nejsou rovnoběžná. Leží napříč a/nebo se spirálovitě obtáčejí kolem sebe a vytvářejí trojrozměrnou vzájemně se ovlivňující nadstavbu, která dodává celé tkáňové matrici maximální pevnost a pružnost (Kannus, 2010; Stecco, 2015).

Elasticita elastinových a kolagenových vláken
- První anatomové byli toho názoru, že šlachy nevykazují elastické vlastnosti. Dnes již není pochyb o elasticitě kolagenové tkáně.
- Elastin a kolagen nejsou více nebo méně pružné, rozdíl je spíše v tom, že elastin a kolagen mají různou tuhost.
- Kolagen je asi stokrát tužší než elastin, což znamená, že dokáže uchovat stejné množství energie, zatímco se natáhne jen na setinu. (Zorn a Hodeck, 2011).
- Kolagenní fibrily (vlákna) nelze zcela natáhnout, musí být přítomna alespoň určitá elasticita, která umožní pohyb. Například šlachy lze natáhnout přibližně o 3-4 %. Odhaduje se, že Achillova šlacha má 4 % elasticitu.
- Elastinová vlákna jsou hydrofobní, tj. odpuzují vodu. V přirozeném (přírodním) stavu jsou elastická vlákna obklopena silnou vrstvou krystalické vody, která chrání strukturální integritu a roztažitelnost vláken.
Retikulin
Je velmi jemné vlákno, typ nezralého kolagenu, který převládá v embryu, ale v dospělosti je z velké části nahrazen kolagenem. O retikulinu si povíme více, až se budeme zabývat vývojem fascií v embryu.
Literatura:
- Benetazzo, L., Bizzego, A., Caro, R. D., & Stecco, C. (2011, December 1). 3D reconstruction of the crural and thoracolumbar fasciae. Springer Verlag. https://www.researchgate.net/publication/49726557_3D_reconstruction_of_the_crural_and_thoracolumbar_fasciae
- Stecco, C. (2015). Functional atlas of the human fascial system. Churchill Livingstone.
- Kannus, P. (2000). Structure of the tendon connective tissue – PubMed. Scandinavian Journal of Medicine & Science in Sports, 10(6). https://doi.org/10.1034/j.1600-0838.2000.010006312.x
- Fede, C., Angelini, A., Stern, R., Macchi, V., Porzionato, A., Ruggieri, P., De Caro, R., & Stecco, C. (2018). Quantification of hyaluronan in human fasciae: Variations with function and anatomical site. Journal of Anatomy, 233(4), 552–556. https://doi.org/10.1111/joa.12866
- Allen, J., & Parisi, B. (2019b). Fascia training: A whole-system approach.
- Lesondak, D., & Akey, A. M. (2020b). Fascia, function, and medical applications. CRC Press.
- McCormick, R. J. (1994). The flexibility of the collagen compartment of muscle – PubMed. Meat Science, 36(1–2). https://doi.org/10.1016/0309-1740(94)90035-3
- Purslow, P. P. (2010). Muscle fascia and force transmission – PubMed. Journal of Bodywork and Movement Therapies, 14(4). https://doi.org/10.1016/j.jbmt.2010.01.005
- Currier, D. P., & Nelson, R. M. (1992). Dynamics of human biologic tissues. F A Davis Company.
- Sullivan, B. E., Carroll, C. C., Jemiolo, B., Trappe, S. W., Magnusson, S. P., Døssing, S., Kjaer, M., & Trappe, T. A. (2009). Effect of acute resistance exercise and sex on human patellar tendon structural and regulatory mRNA expression. Journal of Applied Physiology (Bethesda, Md. : 1985), 106(2), 468–475. https://doi.org/10.1152/japplphysiol.91341.2008
- Heinemeier, K. M., Schjerling, P., Øhlenschlæger, T. F., Eismark, C., Olsen, J., & Kjær, M. (2018). Carbon-14 bomb pulse dating shows that tendinopathy is preceded by years of abnormally high collagen turnover – PubMed. FASEB Journal : Official Publication of the Federation of American Societies for Experimental Biology, 32(9). https://doi.org/10.1096/fj.201701569R
- Ricard-Blum, S. (2011). The collagen family. Cold Spring Harbor Perspectives in Biology, 3(1), a004978. https://doi.org/10.1101/cshperspect.a004978
- Kjaer, M. (2004, May 1). Role of extracellular matrix in adaptation of tendon and skeletal muscle to mechanical loading. American Physiological Society. https://www.researchgate.net/publication/8655575_Role_of_Extracellular_Matrix_in_Adaptation_of_Tendon_and_Skeletal_Muscle_to_Mechanical_Loading
- Stecco, A., Busoni, F., Stecco, C., Mattioli-Belmonte, M., Soldani, P., Condino, S., Ermolao, A., Zaccaria, M., & Gesi, M. (2015). Comparative ultrasonographic evaluation of the Achilles paratenon in symptomatic and asymptomatic subjects: An imaging study – PubMed. Surgical and Radiologic Anatomy : SRA, 37(3). https://doi.org/10.1007/s00276-014-1338-y
- Zorn, A., Schmitt, F.-J., Hodeck, F. H., & Klingler, W. (2008, January 1). The spring-like function of the lumbar fascia in human walking. Elsevier. https://www.researchgate.net/publication/200796932_The_spring-like_function_of_the_lumbar_fascia_in_human_walking

instagram: @philipjerry
facebook: Philip Jerry Stráňavský
linkedin: Filip Stráňavský
twitter: JerryslavFilip

